Enzimas
- Catalizadores biológicos
- Proteínas
- Juntas formam vias metabólicas
- Enzimas são reguladas
Funcionamento de uma enzima
O vídeo mostra, de forma bem sucinta, o funcionamento de
uma enzima. O(s) substrato(s) se ligam a uma região da enzima chamada
SÍTIO ATIVO, que fornece condições favoráveis a que aconteça a reação
desejada. A reação, que demoraria muito tempo para acontecer sem a
interferência da enzima, ocorre e fração de segundos.
Estratégias de regulação de enzimas: Inibição pelo produto (feedbacknegativo)
1.1 - Inibição pelo produto imediato da enzima
1.2 - Inibição pelo produto final da via
- Sítio regulador
- Sítio catalítico
- Aminoácidos catalíticos
- Cinases
- FosfatasesRegulação das vias metabólicas
- Lógica metabólica da regulação das vias metabólicas
- Atividade enzimática
- Unidades de atividade enzimática
Classes de enzimas (segundo tipo de reação que catalizam)
Reação catalizada por enzima
- O sítio ativo
- Aproxima os reagentes
- Remove a água de hidratação dos reagentes
- Orienta os reagentes de forma adequada
- Efeito do aumento da concentração de substrato na velocidade de funcionamento de uma enzimaParâmetros cinéticosKmVmax
Cinética Enzimatica
Vídeo que mostra um pouco da cinética enzimática. Mostra que enquanto mais moléculas de enzima encontram-se ligadas ao substrato, maior será a velocidade da reação. Mostra também o Km (Constante de Michaelis) como uma constante específica de cada enzima e inversamente proporcional à afinidade da enzima ao seu substrato: enquanto maior o Km, menor a afinidade da enzima por seu substrato e vice-versa.
Inibição enzimáticaInibidores competitivos- aumenta Km e não altera V max
- se liga de forma não covalente à enzima (reversível)
Inibidores não competitivos- Diminui Vmax, mas não altera Km
- Se liga covalentemente à enzima (irreversível)
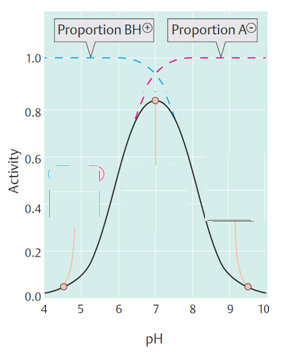
Dependência ao pHDependência à TemperaturaVeja mais vídeos:Estrutura da Lizozima
Este vídeo descreve a estrutura da enzima lisozima e ilustra o mecanismo geral da catálise enzimática. Aminoácidos específicos do sítio ativo induzem as reações, reagindo com grupamentos químicos do substrato que, uma vez presentes no sítio ativo, encontram-se posicionados perfeitamente para que o processo ocorra de uma maneira muito mais favorável, em relação às condições fora do sítio ativo da enzima.












Nenhum comentário:
Postar um comentário